肺癌作为全球癌症致死的首要原因,其药物研发进展总是备受关注。每年9月,全球药企及学者都会赶往肺癌领域的国际盛会——世界肺癌大会(WCLC),分享创新药物的最新突破性成果。
就在本届大会召开前夕,FDA再次强调了总生存期(OS)作为抗肿瘤药物注册性临床试验关键评估指标的重要性,这也使得OS数据成为了WCLC 2025大会的热议话题。这一指标直接关乎癌症患者“活得更久”的核心诉求,并指引着所有药企与研究者的探索方向。
在大会上,EGFR-TKI耐药后非小细胞肺癌(NSCLC)群体的未满足需求再度引起广泛关注。尽管多款药物在会上展现出了极具潜力的临床数据,但遗憾的是,直到大会落幕,也并未出现一种疗法能够相较于标准化疗同步实现无进展生存期(PFS)与OS的双重获益[1]。
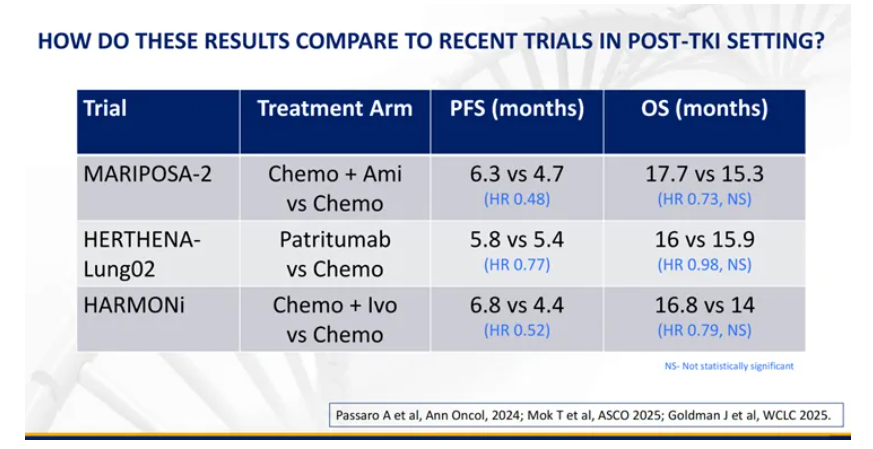
而在短短一个月左右,新的转机已至。
10月11日,科伦博泰的TROP2 ADC药物芦康沙妥珠单抗(sac-TMT,佳泰莱®)顺利拿下第三项适应症——单药治疗经EGFR-TKI治疗后进展的EGFR突变型非鳞状NSCLC患者,成为了全球首款覆盖肺癌二线及以上治疗的TROP2 ADC,为EGFR-TKI耐药人群提供了化疗之外的全新治疗选择。
该适应症顺利获批的基点在于III期OptiTROP-Lung04研究成功达到了PFS显著延长的主要终点。更重要的是,该药物在OS指标上同样实现了显著获益。其III期研究结果也已成功入选2025 ESMO大会Late-Breaking Abstract(LBA),将在Presidential Symposium(主席论坛)上重磅发布。这一突破不仅是中国创新药在肺癌领域的一次重大进阶,也是国产创新药从跟随向领跑转变的又一力证。
国产利刃再出鞘,从后线晋级二线
芦康沙妥珠单抗的肺癌进阶之路,始于其在三线治疗中的卓越表现。关键II期研究(OptiTROP-Lung03)结果显示,相较于单药化疗,该药物可将三线EGFR突变型NSCLC患者的PFS拉长4个月,客观缓解率(ORR)提升近3倍[2]。值得一提的是,与多西他赛组相比,芦康沙妥珠单抗组OS显示出具有统计学意义的显著改善(中位OS均未达到),12个月OS率提高19%,死亡风险降低51%。凭借这一成果,芦康沙妥珠单抗在今年3月获得国家药监局批准用于三线治疗EGFR突变型NSCLC,成为全球首个在肺癌领域获得批准的TROP2 ADC,成功迈出革新肺癌治疗格局的第一步。
这次获批二线适应症,芦康沙妥珠单抗又一次完成了“全球首个”的关键飞跃。支持获批的III期OptiTROP-Lung04研究显示:与当前标准化疗方案相比,芦康沙妥珠单抗单药治疗在PFS和OS两大关键疗效指标上,均取得具有显著统计学意义与临床意义的改善,能切实提升患者的总生存获益。这一积极的疗效结果,使其成为首个针对二线EGFR突变型NSCLC人群实现PFS与OS双重获益的ADC药物,填补了该治疗领域长期存在的关键空白。
在这之前,众多药物曾在III期研究中有过破局尝试。PD-(L)1单抗是最早的探索者,包括帕博利珠单抗[3]、纳武利尤单抗[4]、阿替利珠单抗[5,6]和信迪利单抗[7]四款药物已有III期研究结果披露,但无一能够取得PFS和OS双重获益的结果。
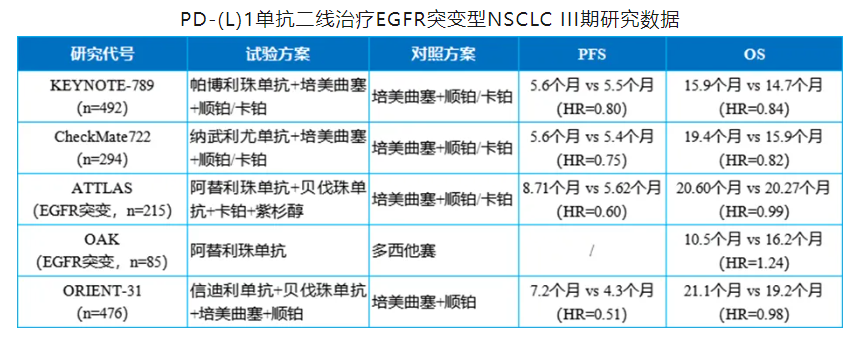
即使是聚焦同一适应症的ADC药物,同为TROP2靶点的德达博妥单抗仍在等待III期研究的最终验证,HER3靶点的Patritumab deruxtecan则因未达到OS的统计学显著性,主动撤回了上市申请,作为赛道的“后来者”,芦康沙妥珠单抗率先打破僵局,取得了亮眼的PFS和OS数据。
而将视野进一步转向国内,尽管已有依沃西单抗、信迪利单抗和埃万妥单抗获批二线治疗EGFR突变型NSCLC,但大多是在PFS指标上与化疗拉开差距[8,9],OS优势并不明朗。另外值得关注的是,上述已上市药物多采取联合用药方案,而芦康沙妥珠单抗仅凭单药即可展现出显著疗效。
这些事实,不仅进一步凸显了其在EGFR突变型NSCLC二线治疗中的出色表现,更充分印证了该药在NSCLC治疗领域的 “硬核实力”。
纵横布局,开拓宏大版图
在肺癌适应症治疗线序上的快速前移,不仅夯实了芦康沙妥珠单抗作为全球首个肺癌领域TROP2 ADC“破局者”的基本盘,也为后续开发路径明确了方向。在BIC潜力的逐步释放下,芦康沙妥珠单抗通过纵横布局,指向更宏大的疾病版图。
从适应症布局的广度来看,其临床研究已覆盖乳腺癌、肺癌、胃癌、子宫内膜癌、宫颈癌、卵巢癌、尿路上皮癌等高发或难治癌种。这不仅由TROP2靶点在多种上皮源性肿瘤中高表达的生物学特性所驱动,也是科伦博泰基于芦康沙妥珠单抗治疗潜能的价值最大化。
从研发布局的深度上,芦康沙妥珠单抗已率先切中临床需求最迫切的肺癌、乳腺癌两大癌种,构建了较为完善的临床开发路径。

沿着肺癌这一适应症深入剖析,就能清晰看到该药的临床开发思路——从后线到前线、从单药到联合的多元覆盖。
二线和三线NSCLC适应症的接连撞线,拉开了芦康沙妥珠单抗全面开拓肺癌领域的序幕。至于更关键的一线场景,芦康沙妥珠单抗正撬动更大的可能性。
目前,科伦博泰已启动多项芦康沙妥珠单抗联合不同药物一线治疗不同类型NSCLC的III期临床试验,包括“ADC+IO王牌组合”芦康沙妥珠单抗+K药针对PD-L1表达阳性(TPS≥1%)NSCLC的OptiTROP-Lung05研究,以及针对PD-L1表达阴性(TPS<1%)NSCLC的OptiTROP-Lung06研究。
此前已有临床数据提示芦康沙妥珠单抗联合IO的协同之效——II期OptiTROP-Lung01研究表明[10],芦康沙妥珠单抗(5mg/kg Q2W)+PD-L1单抗塔戈利单抗一线治疗NSCLC的ORR高达77.6%,且针对不同PD-L1表达水平和不同亚型人群均有不错的疗效。
除了时下热门的“ADC+IO”联合模式,芦康沙妥珠单抗也在探索不同的联用方式,其携手奥希替尼进击EGFR突变NSCLC的一线治疗,或将成为“ADC+靶向小分子”强强联合的典范。值得一提的是,该项III期研究中大胆设计与奥希替尼的头对头对比,不仅为EGFR突变患者突破现有治疗天花板提供了可能,也意味着这款国产创新药正通过挑战主流疗法,迈向更高阶的国际竞争。
全球化征程渐入佳境
国际竞争已成为中国创新药需要直面的关键命题,而早在几年前,芦康沙妥珠单抗就获得国际巨头默沙东的青睐,开启了全球化征程。
2022年5月,默沙东获得该药物在大中华区以外的独家权利。引进之后,默沙东全力挖掘芦康沙妥珠单抗的应用潜力,推进了14项全球多中心III期临床,这一系列密集启动的临床试验释放出一个明确信号——芦康沙妥珠单抗已成为默沙东的临床开发优先级,随着未来几年重磅数据陆续出炉,芦康沙妥珠单抗将朝着下一个肿瘤重磅大药奔去。
针对肺癌这一关键领域,默沙东也进行了重点谋划。从中,我们也得以窥见芦康沙妥珠单抗逐鹿全球的思路所在:
其一,遵循芦康沙妥珠单抗在中国已验证的开发逻辑,顺势而为破局全球EGFR突变耐药治疗;
其二,以前期临床数据为指引,精准锁定接受芦康沙妥珠单抗治疗后能实现显著获益的优势人群,如PD-L1高表达(TPS≥50%)的NSCLC患者,进而扩大其全球影响力;
其三,勇于探索治疗的边界,一步步渗透疾病进展的细分场景,持续提升肺癌治疗标准。

当下,ADC+IO正在重塑肿瘤治疗的格局,这也是默沙东眼中差异化破局的机会。此前,芦康沙妥珠单抗已凭借单药实力,一举击穿了肺癌的后线治疗困局,如今默沙东正乘胜追击,将联合策略拓展至辅助、新辅助等更早期治疗场景——如芦康沙妥珠单抗+ K药辅助治疗术后未达到病理完全缓解NSCLC的TroFuse-019研究。若这一组合能在该项研究中率先验证临床获益,将有望革新NSCLC辅助治疗的标准治疗模式,并向覆盖肺癌完整治疗周期迈进一大步。
从后线突围到一线进发,再到辅助探索的路径开拓,昭示着芦康沙妥珠单抗征战全球肺癌领域的野心,这种层层递进的全球化打法也将复制到更多疾病领域,当下的突破仅仅只是开始。
总结
当越来越多的国产创新药在肺癌、乳腺癌等主战场与跨国药企正面交锋,我们有理由相信,中国药企正日益成为重构全球抗肿瘤药物格局的关键力量,实现从跟随者到领跑者的华丽转身。
芦康沙妥珠单抗的进阶之路,正是这一历史性转变的重要见证。
[1]Suresh S. Ramalingam, NCI Designated Comprehensive Cancer Center
[2]Sacituzumab tirumotecan versus docetaxel for previously treated EGFR-mutated advanced non-small cell lung cancer: multicentre, open label, randomised controlled trial. doi: 10.1136/bmj-2025-085680.
[3]Pemetrexed and platinum with or without pembrolizumab for tyrosine kinase inhibitor (TKI)-resistant, EGFR-mutant, metastatic nonsquamous NSCLC: Phase 3 KEYNOTE-789 study. doi.org/10.1200/JCO.2023.41.17_suppl.LBA9000。
[4]Nivolumab Plus Chemotherapy in Epidermal Growth Factor Receptor-Mutated Metastatic Non-Small-Cell Lung Cancer After Disease Progression on Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitors: Final Results of CheckMate 722.doi: 10.1200/JCO.23.01017.
[5]Phase III, Randomized Study of Atezolizumab Plus Bevacizumab and Chemotherapy in Patients With EGFR- or ALK-Mutated Non-Small-Cell Lung Cancer (ATTLAS, KCSG-LU19-04). doi: 10.1200/JCO.23.01891.
[6]Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. doi: 10.1016/S0140-6736(16)32517-X.
[7]Sintilimab plus chemotherapy for patients with EGFR-mutated non-squamous non-small-cell lung cancer with disease progression after EGFR tyrosine-kinase inhibitor therapy (ORIENT-31): second interim analysis from a double-blind, randomised, placebo-controlled, phase 3 trial. doi: 10.1016/S2213-2600(23)00135-2.
[8] Sintilimab plus chemotherapy for patients with EGFR-mutated non-squamous non-small-cell lung cancer with disease progression after EGFR tyrosine-kinase inhibitor therapy (ORIENT-31): second interim analysis from a double-blind, randomised, placebo-controlled, phase 3 trial. doi: 10.1016/S2213-2600(23)00135-2.
[9]Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase III MARIPOSA-2 study. doi: 10.1016/j.annonc.2023.10.117.
[10]https://meetings.asco.org/abstracts-presentations/232877